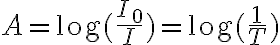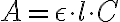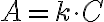Quaderno di Laboratorio Chimico
| Sito: | Progetto Minerva |
| Corso: | Lato Rosa della Scienza 2019 |
| Libro: | Quaderno di Laboratorio Chimico |
| Stampato da: | Utente ospite |
| Data: | venerdì, 6 giugno 2025, 12:58 |
Descrizione
In questa dispensa sono racchiusi norme e consigli per l'uso del laboratorio chimico e delle strumentazioni presenti.
Sommario
1. Norme di sicurezza e consigli pratici nell'uso del laboratorio di chimica
Per svolgere un lavoro sicuro per sé e per i propri compagni, ogni studente deve seguire nel laboratorio di chimica alcune norme di sicurezza e consigli pratici.
Per la sicurezza nel laboratorio di chimica è bene seguire queste fondamentali norme di comportamento:
 Durante l'esecuzione di un esperimento indossare sempre camice, guanti e occhiali di sicurezza.
Durante l'esecuzione di un esperimento indossare sempre camice, guanti e occhiali di sicurezza.- Prima di iniziare qualsiasi attività, accertarsi di avere capito scopo e finalità che l'esperimento si prefigge.
- Seguire scrupolosamente e nell'ordine stabilito tutte le operazioni discusse con l'insegnante necessarie per portare a termine l'esperimento. Non prendere iniziative di alcun genere e non tentare alcuna variante all'esperimento che non sia stata preventivamente approvata dall'insegnante.
- Durante l'attività di laboratorio non portare nulla alla bocca (mani, cibo, bevande, ecc.). Anche i cibi toccati con le mani possono essere stati contaminati da reagenti chimici e quindi potenzialmente dannosi per la salute.
- Fare molta attenzione quando si utilizzano liquidi infiammabili. Nelle esercitazioni in cui è previsto l'uso di solventi infiammabili (acetone, alcol, etere di petrolio, ecc.) tutti i bunsen devono essere spenti.
- Minimizzare l'inquinamento dell'ambiente privilegiando esercitazioni in scala ridotta. Disporre in laboratorio opportuni recipienti di raccolta per le sostanze tossiche ed inquinanti. Questi recipienti vanno consegnati a ditte specializzate per lo smaltimento.
- Maneggiare con cura le apparecchiature di vetro facendo attenzione a non tagliarsi. Se le apparecchiature in vetro sono state appena ritirate dalla fiamma, appoggiarle su una reticella isolante e non direttamente sul banco di lavoro.
 Non aspirare mai i vapori che possono svilupparsi in una reazione chimica o che possono essere esalati da alcuni contenitori; in questi casi è opportuno lavorare sotto cappa aspirante.
Non aspirare mai i vapori che possono svilupparsi in una reazione chimica o che possono essere esalati da alcuni contenitori; in questi casi è opportuno lavorare sotto cappa aspirante.- Non lavorare da soli in laboratorio. In caso di incidente nessuno vi potrà soccorrere.
- Per il travaso di liquidi fare scorrere il liquido lungo una bacchetta di vetro o, per volumi di liquido maggiori, farlo scorrere lungo le pareti del recipiente.
- Avvertire l'insegnante in caso di incidente.
- Tenere ogni cosa pulita ed in ordine; in particolare il banco di lavoro deve essere sgombero da reagenti e apparecchiature inutilizzate.
- Estintori, doccia, cassetta di pronto soccorso, uscite di sicurezza devono essere facilmente raggiungibili e accessibili.
- Nella diluizione dell'acido solforico, versare sempre l'acido nell'acqua e non viceversa poiché la solubilizzazione è fortemente esotermica.
- Quando si utilizza una pipetta, non aspirare i liquidi con la bocca ma con l'ausilio della propipetta.
- Utilizzare spatole pulite per prelevare dai contenitori i reagenti solidi. Al fine di non inquinare il contenuto dei recipienti, la stessa spatola non deve essere mai utilizzata per il prelievo di più sostanze diverse.
2. Norme di sicurezza nell'uso del Bunsen
La più comune apparecchiatura utilizzata nei laboratori di chimica per il riscaldamento di sostanze è il becco Bunsen.
Nell'uso del becco Bunsen bisogna seguire determinate norme di sicurezza, poichè un uso inadeguato dello strumento può essere altamente pericoloso.
Norme di comportamento nell'uso del becco Bunsen
 Di seguito vengono elencate le principali norme di comportamente da seguire durante l'utilizzo del becco Bunsen:
Di seguito vengono elencate le principali norme di comportamente da seguire durante l'utilizzo del becco Bunsen:
Prima di accendere la fiamma del Bunsen accertarsi che nelle vicinanze non vi siano sostanza infiammabili e contenitori di sostanze volatili come ad esempio alcol, acetone, benzina, etere di petrolio, ecc.
Durante l'accensione del Bunsen chiudere la ghiera per l'ingresso dell'aria; aprire solo parzialmente il rubinetto di erogazione del gas; avvicinare lateralmente e all'estremità inferiore del cannello il fiammifero acceso tenendo il viso lontano dal Bunsen. Utilizzare una reticella spargifiamma per il riscaldamento di beute o di palloni.
Durante l'uso del Bunsen aprire la ghiera per permettere l'ingresso dell'aria: la fiamma diventa di colore azzurro. Tenere il Bunsen acceso solo quando necessario. Se ci si allontana momentaneamente dal banco di lavoro rendere la fiamma gialla e quindi facilmente visibile chiudendo la ghiera per l'ingresso dell'aria.

Non riscaldare mai recipienti chiusi: a causa del riscaldamento, all'interno del recipiente, si potrebbe verificare un aumento di pressione tale da riuscire a far saltare il tappo e fare fuoriuscire in modo violento il contenuto del recipiente. In casi estremi e altamente pericolosi si potrebbe verificare anche lo scoppio del recipiente stesso.
Non scaldare mai sostanze sconosciute.
Durante il riscaldamento di una sostanza contenuto all'interno di un recipiente non rivolgere mai l'imboccatura del recipiente verso di sè o verso i compagni di lavoro. Non guardare dentro al recipiente fissandolo dall'imboccatura.
Quando si riscalda il contenuto di una provetta, servirsi dell'apposita pinza di legno. Agitare la provetta sulla fiamma in modo da avere un riscaldamento omogeneo.
3. Simboli di pericolosità delle sostanze chimiche
I contenitori dei reagenti chimici sono muniti di etichette nelle quali sono indicati simboli convenzionali secondo cui le sostanze sono classificate in base alla loro pericolosità. Esistono otto categorie diverse: sostanze esplosive, sostanze infiammabili, sostanze comburenti o ossidanti, sostanze tossiche, sostanze nocive, sostanze irritanti, sostanze corrosive e sostanze radioattive.
Il Regolamento della Comunità Europea n. 1272/2009, noto come CLP (Classification, Labelling and Packaging), ha modificato i pittogrammi per i simboli di pericolo. I nuovi pittogrammi stanno quindi sostituendo gradualmente i vecchi piottogrammi.
I VECCHI E I NUOVI PITTOGRAMMI DI PERICOLO
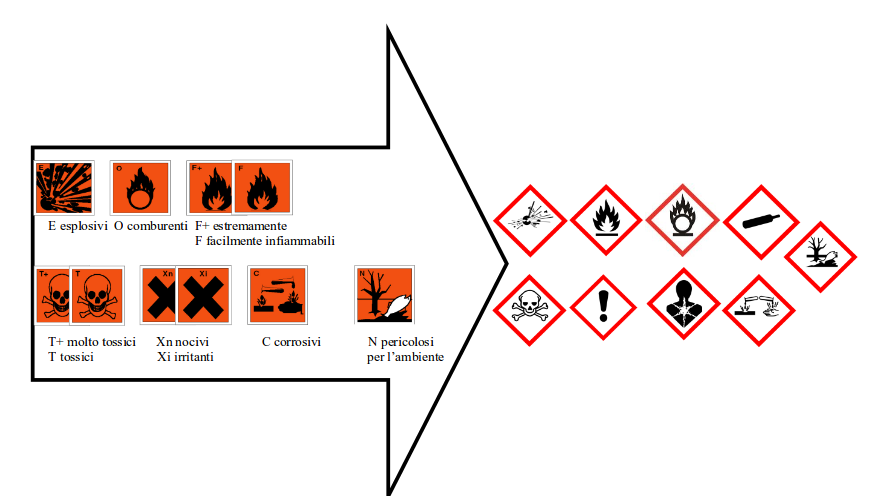
Alcuni dei nuovi pittogrammi assomigliano ai vecchi simboli, attenzione però che non rappresentano per forza gli stessi pericoli e che non sono sistematicamente associati agli stessi prodotti chimici (vedi Tabella finale).
Nella nuova etichetta oltre ai nuovi pittogrammi compaiono le parole di avvertimento o “avvertenze”:
- pericolo;
- attenzione;
dove la scritta “pericolo” sta ad indicare i prodotti chimici più pericolosi.
Anche le “Frasi R di rischio” e le “Frasi S o Consigli di prudenza” vengono sostituite rispettivamente dalle “Indicazioni di pericolo H”e dai “Consigli di prudenza P”, che come in precedenza hanno il compito di indicare i pericoli e le misure di prevenzione da mettere in atto per la conservazione, la manipolazione, lo smaltimento e cosa fare in caso di incidente. Nella nuova etichetta inoltre vengono aggiunte alle Indicazioni H e P “Ulteriori informazioni sui pericoli EUH” cioè frasi associate a sostanze o miscele pericolose con proprietà chimico-fisiche o tossicologiche specifiche.
Esempi di Indicazioni di pericolo o Frasi H:
- H224 Liquido e vapori altamente infiammabili
- H334 Può provocare sintomi allergici o asmatici o difficoltà respiratorie se inalato
- H400 Molto tossico per gli organismi acquatici
Esempi di Consigli di prudenza o Frasi P:
- P260 Non respirare le polveri
- P302 + P350 In caso di contatto con la pelle lavare delicatamentee abbondantemente con acqua e sapone
- P405 Conservare sotto chiave
Esempi di Ulteriori informazioni sui pericoli o Frasi EUH:
- EUH031 A contatto con acidi libera un gas tossico
- EUH201 Contiene piombo. Non utilizzare su oggetti che possono essere masticati o succhiati dai bambini
- EUH059 Pericoloso per lo strato dell’ozono
| Pericoli | Simbolo Vecchio | Simbolo Nuovo |
| Pericolo di esplosione. Questi prodotti possono esplodere a contatto di una fiamma, di una scintilla, dell’elettricità statica, sotto l’effetto del calore, di uno choc, di uno sfregamento. |
 |
 |
| Pericolo d’incendio Questi prodotti possono infiammarsi: a contatto di una fiamma, di una scintilla, di elettricità statica, sotto l’effetto del calore, o di sfregamenti. |
 |
 |
| Prodotti comburenti. Questi prodotti possono provocare o aggravare un incendio, o anche provocare un’esplosione se sono in presenza di prodotti infiammabili o combustibili. |
 |
 |
| Gas sotto pressione. Questi prodotti sono gas sotto pressione in un recipiente e possono esplodere sotto l’effetto del calore. Si tratta di gas compressi, di gas liquefatti e di gas di sciolti. I gas liquefatti possono, quanto tali, essere responsabili di bruciature o di lesioni legate al freddo dette criogeniche. |
 |
|
| Pericolo di tossicità acuta. Questi prodotti avvelenano rapidamente anche con una bassa dose. Essi possono provocare degli effetti molto vari sull’organismo: nausea, vomito, mal di testa, perdita di conoscenza, o altri disturbi importanti compresa la morte. Questi prodotti possono esercitare la loro tossicità per via orale, inalatoria e cutanea. |
 |
 |
| Pericoli gravi per la salute. Questi prodotti possono:
|
 |
|
| Pericoli per la salute. Questi prodotti chimici possono: avvelenare ad una dose elevata, provocare delle allergie cutane e o causare sonnolenza o vertigini, provocare una reazione infiammatoria per gli occhi, la gola, il naso o la pelle a seguito del loro contatto diretto, prolungato o ripetuto con la pelle o le mucose. |
|
 |
| Pericolo di corrosione. Questi prodotti sono corrosivi perché attaccano o distruggono i metalli e corrodono la pelle e/o gli occhi in caso di contatto o di proiezione. |
 |
 |
| Pericoli per l’ambiente. Questi prodotti provocano effetti nefasti sugli organismi dell’ambiente acquatico (pesci, crostacei, ...) e sullo strato dell’ozono. |
 |
 |
Attenzione certi pericoli non sono indicati da un pittogramma. Per questo è importante leggere tutta l’etichetta!
Alcuni pericoli non sono indicati da un pittogramma ma vengono segnalati dalle Frasi H (Indicazioni di Pericolo) o dalle Frasi EUH (Ulteriori informazioni di pericolo). E’ il caso della miscelazione di prodotti incompatibili, quali per esempio la Varechina con sostanze acide, che provoca lo sviluppo di un gas tossico, il Cloro. Questo è un tipico incidente chimico, comune sia in ambiente domestico che lavorativo. Tale rischio viene segnalato dalla frase: EUH 031 A contatto con acidi libera un gas tossico.
UN DOCUMENTO PER SAPERNE DI PIU’: LA SCHEDA DAI DATI DI SICUREZZA.
Se l’etichetta serve a comunicare il pericolo dei prodotti chimici a colpo d’occhio, maggiori informazioni possono essere acquisite tramite la Scheda dei dati di sicurezza. Questa è un documento di qualche pagina che deve essere fornito all’utilizzatore professionale da parte di chi immette sul mercato una sostanza o una prodotto pericolosi. La troviamo quindi sul posto di lavoro. Consultiamola!

4. Vetreria e strumenti utilizzati nei laboratori di chimica
L'uso corretto degli strumenti e delle attrezzature nei laboratori di chimica è indispensabile per la corretta realizzazione di un esperimento.
 Essi possono essere strumenti per la miscelazione (come gli agitatori magnetici), strumenti per la separazione di miscugli (distillatori, centrifughe, filtri, ecc.), strumenti di misurazione (termometri, burette, matracci, ecc.), strumenti per lo scambio termico (come ad esempio stufe e muffole), strumenti per il traferimento o il trattamento di sostanze (becher, bute, imbuti, provette, ecc.) e strumenti per il supporto.
Essi possono essere strumenti per la miscelazione (come gli agitatori magnetici), strumenti per la separazione di miscugli (distillatori, centrifughe, filtri, ecc.), strumenti di misurazione (termometri, burette, matracci, ecc.), strumenti per lo scambio termico (come ad esempio stufe e muffole), strumenti per il traferimento o il trattamento di sostanze (becher, bute, imbuti, provette, ecc.) e strumenti per il supporto.
Di ognuno di essi il chimico deve conoscere modalità di utilizzo e funzionalità.
Vengono di seguito proposte la principale vetreria e i pricipali strumenti di uso comune utilizzati nei laboratori di chimica:
- Strumenti per la miscelazione;
- Agitatore magnetico
- Mortaio con pestello
- Strumenti per la separazione;
- Centrifuga
- Apparecchiatura per la distillazione
- tubo refrigerante
- Essiccatore
- Filtro Buchner
- Inbuto separatore
- Strumenti di misurazione;
- Bilancia
- Buretta
- Cilindro graduato
- Densimetro
- Matraccio
- Piaccametro
- Polarimetro
- Spettrofotometro
- Termometro
- Strumenti per lo scambio termico;
- Bagno termostatico
- Becco Bunsen
- Stufa termostatica
- Muffola
- Strumenti per il trasferimento o il trattamento di sostenze;
- Becher
- Beuta
- Capsula di porcellana
- Crogiolo
- Imbuto
- Pallone
- Pipetta
- Pipetta Pasteur
- Propipetta
- Provetta
- Spruzzetta
- Vetrino da orologio
- Strumenti per il supporto.
- Pinze
- Treppiede
4.1. Strumenti per la miscelazione
Agitatore magnetico
 L'agitatore magnetico è una apparecchiatura utilizzata nei laboratori di chimica per mescolare una o più sostanze (di cui almeno una allo stato liquido).
L'agitatore magnetico è una apparecchiatura utilizzata nei laboratori di chimica per mescolare una o più sostanze (di cui almeno una allo stato liquido).
E' costituito da un piatto metallico dotato di un campo magnetico che permette la rotazione di una ancoretta magnetica posta sul fondo di un contenitore al cui interno vengono poste le sostanze da mescolare.
L'efficacia dell'agitazione è determinata dalla velocità con cui l'ancoretta viene fatta ruotare e dalle dimensioni dell'ancoretta stessa.
 La velocità di rotazione dell'ancoretta può essere regolata mediante una apposita manopola posta alla base dell'agitatore stesso.
La velocità di rotazione dell'ancoretta può essere regolata mediante una apposita manopola posta alla base dell'agitatore stesso.
Piastra riscaldante
La velocità di rotazione dell'ancoretta può essere regolata mediante una apposita manopola posta alla base dell'agitatore stesso.
La temperatura del riscaldamento e la velocità di rotazione dell'ancoretta sono regolate da due manopole indipendenti tra loro. Si può pertanto optare, a seconda delle necessità, per la sola rotazione dell'ancoretta, per il solo riscaldamento del miscuglio o per entrambe le funzioni contemporaneamente.

Mortaio con pestello
Il mortaio è un recipiente a forma emisferica, con fondo piano e pareti robuste, munito di becco di travaso.
Possono essere di vetro, ferro, marmo, ma i più comuni sono quelli in ceramica con la parte interna smaltata.
Nell'estremità superiore il mortaio può avere diametri compresi tra 6 e 20 cm. E' munito di un pestello e viene utilizzato per polverizzare e mescolare in modo uniforme le sostanze solide.

Il fondo interno del mortaio è leggermente tondeggiante per facilitare l'azione triturante del pestello.
Pestello
Il pestello è una corta mazzetta dello stesso materiale del mortaio costituita da una impugnatura e da un'estremità più larga che va inserita all'interno del mortaio.
Durante l'utilizzo del mortaio si consiglia di poggiarlo su una superficie stabile e piana.
Polverizzazione tramite mortaio
La funzione principale del mortaio è quella di polverizzare sostanze solide. Prima di procedere alla polverizzazione della sostanza, bisogna innanzitutto procedere alla sua frantumazione che viene eseguita battendo in modo delicato il solido con il pestello all'interno del mortaio poggiato saldamento al banco di lavoro.
Solo dopo avere frantumato la sostanza si può procedere alla polverizzazione della stessa: tale operazione viene effettuata tramite un movimento rotatorio del pestello che polverizza la sostanza per pressione e sfregamento sulle pareti. Prolungando questa seconda fase è possibile ottenere il solido finemente polverizzato.
4.2. Strumenti per la separazione
Centrifuga
Descrizione e funzionamento della centrifuga
La centrifuga da laboratorio è una apparecchiatura utilizzata nel processo di separazione chiamato centrifugazione.
Essa è costituita da una crociera che consente l'alloggiamento di speciali provette (provette da centrifuga) disposte a 45° o a 90° rispetto all'asse della crociera
Azionando la centrifuga, la crociera inizia a ruotare sul proprio asse con una velocità di circa 4000 - 5000 giri al minuto.
Se all'interno delle provette è stato inserito ad esempio un miscuglio eterogeneo solido-liquido (es. acqua-fango), l'azione della forza cantrifuga spinge il solido verso il fondo della provetta permettendo, in tal modo, la separazione della fase solida da quella liquida.
Il surnatante (liquido) viene in questo modo separato dal precipitato (solido).
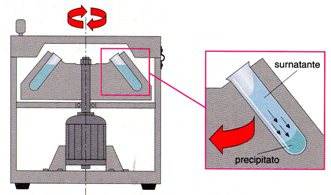
L’uso delle centrifughe consente la separazione delle due fasi del miscuglio in tempi molto brevi; queste apparecchiature infatti permettono di sviluppare una forza generata da un moto circolare uniforme (forza centrifuga) molto più elevata rispetto alla forza di gravità terrestre.
Tipi di rotori
I tipi di rotori delle centrifughe possono essere di vario tipo:
- ad angolo fisso (come nella figura precedente), in cui le provette sono poste in alloggiamenti inclinati a 45°.
- verticali, in cui le provette sono poste in alloggiamenti disposti in verticale. Hanno l'inconveniente che, terminata la centrifugazione, il precipitato si ritrova attaccato alla parete laterale della provetta.
- a braccio oscillante, in cui la provetta contenente il campione, si trova inizialmente in posizione verticale. In fase di centrifugazione, grazie ad un braccio oscillante, la provetta si dispone in posizione orizzontale, a 90° rispetto all'asse di rotazione. Terminata la centrifugazione, durante la fase di decelerazione del rotore, la provetta torna in posizione verticale.
Apparecchiatura per la distillazione
La distillazione consente di separare i componenti di una soluzione sfruttando la loro diversa volatilità (per volatilità si intende la tendenza di una sostanza a evaporare: i liquidi a basso punto di ebollizione possiedono un'alta volatilità).
È una tecnica di separazione molto utilizzata sia nei laboratori di chimica che a livello industriale e viene spesso usata per separare due liquidi miscibili che hanno diverse temperature di ebollizione. Per esempio si possono separare i componenti del miscuglio acqua-alcol etilico. I liquori come brandy, whisky e grappa si chiamano distillati proprio perché si ottengono attraverso processi di distillazione.
Con la tecnica della distillazione è anche possibile separare il solvente di una soluzione dai soluti o per frazionare sistemi normalmente allo stato gassoso dopo averli liquefatti. Un esempio è la separazione di azoto e di ossigeno previa liquefazione dell'aria.
Anche i componenti del petrolio possono essere separati tramite distillazione.
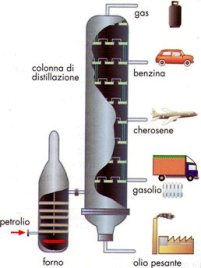
Dalla sommità della colonna di distillazione di un impianto di raffineria escono i componenti a minor temperatura di ebollizione, come i gas combustibili e la benzina; dal fondo della colonna di distillazione escono invece i componenti con punto di ebollizione più elevato, come il gasolio e l'olio pesante.
Tecniche di distillazione
Ci sono diverse tecniche di distillazione, che si differenziano a seconda dei composti da separare. Le tre più importanti sono:
- la distillazione semplice
- la distillazione frazionata
- la distillazione in corrente di vapore
Distillazione semplice
La distillazione semplice, detta anche distillazione a pressione ordinaria, è una tecnica utilizzata nei laboratori di chimica per separare il solvente di una soluzione dai soluti.
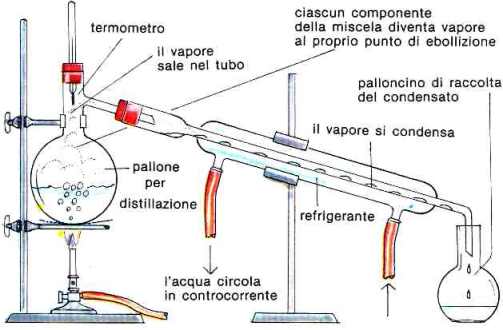
Può essere utilizzata anche per separare liquidi miscibili con punti di ebollizione che differiscono di almeno 25°C. L'apparecchiatura utilizzata è la seguente:
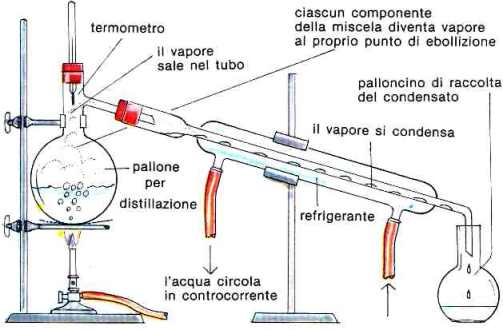
Distillazione semplice: come si procede
Il miscuglio omogeneo da separare viene inserito all'interno di un pallone per distillazione che viene riscaldato tramite becco Bunsen.
Per rendere omogenea l'ebollizione della soluzione, il pallone deve essere riempito per circa metà del suo volume e alla soluzione devono essere aggiunte piccole sferette di pomice o vetro.
Il pallone per distillazione è chiuso da un tappo forato in cui passa un termometro il cui bulbo deve trovarsi immerso nei vapori. In questo modo è possibile determinare la temperatura dei vapori e quindi la temperatura di ebollizione del liquido.
Nel caso della separazione di due liquidi miscibili, i vapori della soluzione sono ricchi del componente a maggior volatilità (ma contengono anche piccole percentuali del componente meno volatile) e vengono condensati nel tubo refrigerante e successivamente raccolti nel palloncino di raccolta del condensato.
Nel caso della distillazione di una soluzione formata da un liquido contenente sali disciolti, la separazione del solvente è invece completa.
Distillazione frazionata
La distillazione frazionata è utilizzata per separare i componenti delle soluzioni formate da liquidi miscibili ottennendo gradi di purezza molto elevati.
L'apparecchiatura utilizzata è la stessa della distillazione semplice, ma con l'aggiunta di una colonna di rettifica che viene inserita tra il pallone di distillazione e il tubo refrigerante (condensatore).
Le colonne di rettifica possono essere di due tipi:
- la colonna Vigreux che è costituita da un semplice tubo di vetro che presenta una serie di sporgenze interne che hanno la funzione di aumentare la superficie di contatto con i vapori
- la colonna a riempimento che è un tubo di vetro liscio riempito interamente di palline di vetro che hanno la funzione di aumentare la superficie di contatto tra il vapore ascendente e il liquido di riflusso.
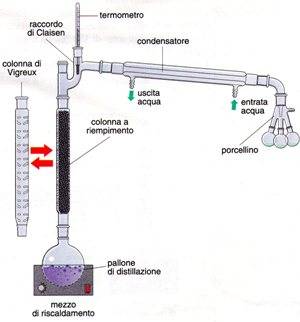
Se la soluzione da distillare è costituita da due componenti, il vapore che si forma durante il riscaldamento li contiene entrambi, perché entrambi sono volatili; i vapori vengono fatti passare attraverso la colonna di rettifica. All'interno di essa, i vapori salendo si raffreddano e subiscono continue condensazioni ed evaporazioni, che portano alla formazione di un vapore sempre più ricco del componente più volatile, cioè del componente che ha la temperatura di ebollizione più bassa; il liquido che condensa è invece più ricco del componente meno volatile.
In altre parole i vapori che salgono verso l'alto incontrano le palline di vetro e si raffreddano. Il componente meno volatile si condensa, cade verso il basso e incontra i nuovi vapori in risalita. Questi, raffreddandosi, cedono al liquido il componente meno volatile. Alla sommità della colonna arrivono solo i vapori del componente più volatile. Questi vapori vengono successivamente condensati nel tubo refrigerante (condensatore) e convogliati nel recipiente di raccolta.
Se la colonna è sufficientemente lunga, i vapori che arrivono in cima ad essa sono formati dal solo componente più volatile e il termometro ne misura la temperatura di ebollizione. Fin quando la temperatura rimane costante, sta distillando solo il componente più volatile; quando comincia ad aumentare la temperatura dei vapori, vuol dire che la distillazione è terminata. A questo punto si può interrompere il processo, la separazione dei due componenti della soluzione iniziale si è realizzata.
Distillazione in Corrente di Vapore
La distillazione in corrente di vapore sfrutta il fenomeno secondo cui la temperaura di ebollizione di una miscela costituita da due liquidi immiscibili è più bassa della temperatura di ebollizione del solo componente più volatile. Ad esempio la temperautra di ebollizione del benzolo è di 85°C (P = 1atm) e quella dell'acqua è 100°C; la miscela invece bolle a circa 66°C, temperatura più bassa del componente più volatile (benzolo).
La distillazione in corrente di vapore viene sfruttata per estrarre da una miscela o per purificare composti termolabili, cioè composti che si decompongono alla loro temperatura di ebollizione.
In essa una corrente di vapore creata nel pallone A viene fatta gorgogliare nella miscela liquida (contenente il composto da estrarre) del pallone B anch'esso riscaldato.
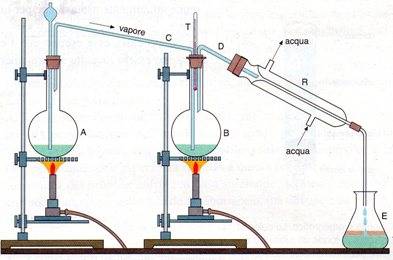
I vapori di acqua e della sostanza termolabile che si vengono a formare, vengono condensati nel tubo refrigerante e convogliati nel recipiente di raccolta (E).
I componenti del distillato raccolto (acqua + sostanza termolabile) sono tra loro immiscibili e possono essere separati mediante un imbuto separatore.
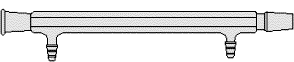
Tubo refrigerante
Il tubo refrigerante è una apparecchiatura in vetro costituita da due tubi concentrici utilizzata nel processo della distillazione.
Nel tubo interno circolano i vapori da condensare mentre in quello esterno, di forma cilindrica, circola il refrigerante (solitamente acqua corrente). Sul tubo esterno sono presenti anche due tubulature laterali necessarie per l'ingresso e l'uscita dell'acqua corrente (refrigerante).
Il tubo interno è solitamente di forma cilindrica ma può anche essere a bolle o a spirale.
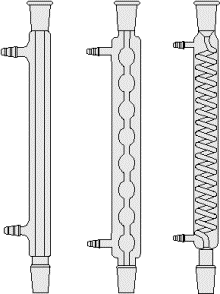
Se il tubo interno è a bolle o a spirale, viene aumentata la superficie di contatto del vapore con il refrigerante e quindi viene facilitata la condensazione dei vapori.
Il tubo refrigerante è una apparecchiatura fondamentale nel dispositivo di distillazione.
Essiccatore
L'essiccatore è un robusto contenitore di vetro, a pareti molto spesse e provvisto di coperchio. L'essicatore viene utilizzato nei laboratori di chimica per allontanare i residui di acqua trattenuta da un solido dopo il processo di filtrazione.
Per fare in modo che il coperchio e l'essiccatore aderiscano perfettamente, sono entrambi provvisti di bordi smerigliati che vengono spalmati o con paraffina o con vasellina.

Il coperchio è talvolta munito di un rubinetto da collegare ad una pompa da vuoto per permettere l'estrazione dell'aria dall'interno dell'essiccatore e facilitare in questo modo l'evaporazione del solvente.
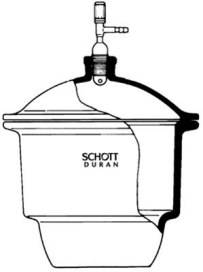
Sul fondo dell'essiccatore, sotto una piastra forata di porcellana, si pone una sostanza igroscopica (CaCl2, Na2SO4 e altre). Molto usata come sostanza igroscopica è il gel di silice addizionato di sali di cobalto. I sali di cobalto hanno la caratteristica di cambiare il proprio colore dal blu al rosa in funzione del loro grado di idratazione; in questo modo danno un'indicazione visiva dell'efficacia disidratante del gel di silice.

Per rigenerare il gel di silice e ristabilire la sua efficacia disidratante deve essere mantenuto in stufa elettrica, ad alta temperatura, per svariate ore.
Il composto, distribuito su un vetro da orologio, viene sistemato invece sulla piastra forata di porcellana.
Nel recipiente che viene chiuso con l'apposito coperchio, la sostanza igroscopica assorbe il vapore d'acqua presente nell'aria favorendo in questo modo l'evaporazione dell'acqua trattenuta dal solido.
Filtro Buchner
Il filtro Buchner è un imbuto filtrante di porcellana a fondo piano bucherellato e pareti robuste.

Viene utilizzato nella filtrazione alla pompa (filtrazione sottovuoto).
Per effettuare la filtrazione, l'imbuto viene inserito, a tenuta mediante una opportuna guarnizione, su una beuta codata (beuta da vuoto). All'interno del fondo dell'imbuto, poggiato sulla parete bucherellata, si inserice un disco di carta da filtro che deve essere subito inumidito e deve essere di dimensioni tali da toccare i bordi del filtro.
Collegando la beuta codata ad una pompa da vuoto (solitamente si tratta di una pompa ad acqua) è possibile effettuare una filtrazione molto rapida, nella quale il liquido passa attraverso il filtro mentre il solido si deposita su di esso.
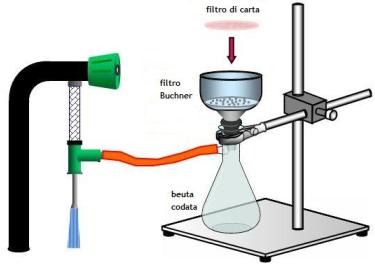
Le dimensioni dell'imbuto devono essere rapportate alla quantità di precipitato da raccogliere, il quale, in ogni caso, deve coprire interamente la superficie filtrante dello stesso.
Imbuto Buchner in vetro
Un imbuto analogo, ma che non richiede la carta da filtro, può realizzarsi in vetro con fondo poroso.

Imbuto separatore
L' imbuto separatore è un contenitore in vetro di forma conica chiuso in alto tramite un tappo di vetro smerigliato e nel gambo, costituito da un tubo solitamente lungo e stretto, è presente un rubinetto. Ne esistono in commercio di varia capacità: dai 100 mL ai 2000 mL.
Viene utilizzato, nelle normali attività di laboratorio, per separare liquidi non miscibili (es. acqua e olio). All'interno dell'imbuto separatore, i due liquidi si stratificano: sul fondo del recipiente si depositerà il liquido con densità maggiore mentre in superficie rimane il liquido più leggero.

Come si utilizza un tubo separatore
L'imbuto separatore lo si fissa ad un apposito sostegno per imbuti separatori e il rubinetto viene leggermente aperto. Il liquido più pesante viene raccolto all'interno del contenitore posto sotto l'imbuto separatore. Una volta raccolto tutto il liquido più denso, si chiude il rubinetto e si cambia il contenitore posto sotto l'imbuto. Si procede quindi alla raccolta del liquido meno denso.
Campi di impiego dell'imbuto separatore
L'imbuto separatore viene utilizzato nei laboratori di chimica nel processo di estrazione con solvente.
L'estrazione con solvente è una tecnica utilizzata per separare da una miscela acquosa un soluto. A tal fine, si sceglie un solvente insolubile in acqua, ma capace di sciogliere il soluto. La miscela acquosa e il solvente vengono inizialmente agitati insieme nell'imbuto separatore e successivamente lasciati a riposo per un determinato periodo tempo. Si ottengono due strati nettamente separati.
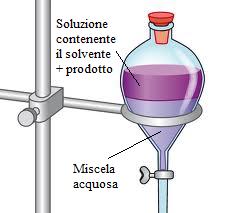
I due strati vengono successivamente separati agendo sul rubinetto dell'imbuto separatore.
4.3. Strumenti di misurazione
Bilancia
La bilancia è lo strumento che permette la misura della massa.
Nei laboratori di chimica le bilance più utilizzate sono le bilance digitali, costitutite da un unico piatto. Sono strumenti estremamente delicati che vanno utilizzati quindi con molta cura.
Le sostanze chimiche non possono essere messe direttamente sul piatto della bilancia, pertanto si adopera un contenitore di raccolta, solitamente un vetrino da orologio, un becher o una capsula di porcellana.
Fasi per effettuare una pesata
Inizialmente sul piatto della bilancia si pone il contenitore di raccolta e successivamente si esegue l'azzeramento (tara).
Si introduce all'interno del contenitore di raccolta la sostanza di cui si vuole determinare la massa.
Sul display della bilancia si leggerà direttamente la massa della sostanza.
I vantaggi di questo tipo di bilance consistono in una notevole semplicità e velocità di impiego e nella possibilità del controllo automatico della tara.
Bilance tecniche e analitiche
A seconda della loro sensibilità, le bilance possono essere catalogate in bilance tecniche e bilance analitiche.
Le bilance tecniche sono sensibili al centesimo di grammo.

Le bilance analitiche sono sensibili al decimo di milligrammo.

Le bilance analitiche sono dotate di piedini di livellamento regolabili e di due sportelli laterali scorrevoli che una volta chiusi consentono di effettuare la pesata evitando fluttuazioni di peso dovute allo spostamento dell'aria.
Possono fornire il risultato della pesata in : grammi, carati, once, libbre, pennyweight, once troy, grani, tael. Tramite un apposito tasto è possibile impostare l'unità di misura desiderata.
Buretta
Le burette sono lunghi tubi di vetro cilindrici del volume medio di 50 mL, graduati in decimi di millimetro. Sono muniti nella parte inferiore di un rubinetto mentre la numerazione inizia all'estremità superiore.
La parte del tubo posta dietro la calibrazione è solitamente provvista di una striscia longitudinale blu su sfondo bianco chiamata "banda di Schellbach" utile per eseguire correttamente letture del volume del liquido.

Come si usano le burette:
La buretta deve essere inizialmente fissata, a circa 2/3 della sua lunghezza, all'asta metallica mediante pinze a morsetto.

Assicurarsi che il rubinetto, posto nella parte inferiore della buretta sia completamente chiuso.
Utilizzando un imbuto, versare lentamente il liquido all'interno della buretta sino ad arrivare quasi sino all'orlo superiore cercando di evitare la formazione di bollicine all'inteno del liquido. Se queste si vengono a formare, bisogna staccarle picchiettando ripetutamente e delicatamente la buretta. Le bollicine, staccandosi dalle pareti, risaliranno in superficie.
Sistemare un becher sotto la buretta. Aprire rapidamente e completamente il rubinetto in modo che la parte della buretta sottostante il rubinetto si riempia completamente del liquido. In caso contrario, ripetere l'operazione.
Portare il menisco sullo zero della scala graduata spillando o rabboccando il liquido all'interno della buretta. L'esecuzione della lettura deve essere fatta in corrispondenza della parte inferiore del menisco. Evitare errori di parallasse posizionando lo sguardo all'altezza del menisco.
Se sulla buretta è presente la "banda di Schellbach", la lettura deve essere fatta in corrispondenza del punto di incontro delle due frecce che si vengono a creare.

Aprire lentamente il rubinetto ed erogare il liquido fino al valore desiderato.
Ripetere la lettura della buretta.
Cilidro graduato
I cilindri graduati sono recipienti solitamente in vetro (ma talvolta in plastica) con forma cilindrica e a base larga.
Sono muniti di beccuccio per il travaso di liquidi.
Sono recipienti graduati, pertanto presentano lungo la parete un insieme di tacce che indicano il volume. La loro capacità può variare dai 10 ai 1000 mL.
Cilindri graduati con tappo
Alcuni tipi di cilindri graduati sono muniti di tappo in polipropilene.

Meno comuni sono i cilindri graduati in vetro con tappo a vite.

Densimetro
Il densimetro è uno strumento utilizzato per la misura della densità di liquidi ma talvolta anche di gas e di solidi.
Il densimetro per liquidi è costituito da un galleggiante zavorrato dotato di scala graduata e talvolta di termometro.
Immergendo il densimetro nel liquido, esso galleggia verticalmente. La lettura della densità viene fatta direttamente sulla scala graduata presente nella parte superiore del densimetro nel punto indicato dal livello del liquido.
Rilevare la temperatura del liquido è fondamentale, in quanto il valore della densità di un corpo dipende dalla sua temperatura.

Per misurare la densità dei solidi si usano l'areometro di Nicholson, il picnometro e la bilancia di Archimede.
Matraccio
I matracci tarati sono contenitori di forma sferica e fondo piano, con collo lungo. Sono solitamente provvisti di tappo smerigliato.
Sul collo è presente una tacca ben visibile (tacca di taratura) che indica in modo preciso, la capacità del contenitore che può variare dai 25 ai 2000 mL.
I matracci tarati vengono usati per la preparazione di soluzioni a concentrazione nota.
Come si usano i matracci:
- Per mezzo di un imbuto e facendo in modo che la parte terminale del suo gambo stia al di sotto della tacca di taratura, si versa il liquido fino a raggiungere la parte iniziale del collo. Bisogna fare molta attenzione a questa operazione evitando di creare gocce di liquido al di sopra della tacca di taratura poichè, in questo caso, si commetterebbe un errore nella quantità di liquido aggiunto (che sarà superiore a quello desiderato).
A causa della tensione superficiale, il liquido aderisce alle pareti del collo di vetro creando una superficie non piana ma curva (menisco). Il fenomeno è tanto più evidente quanto minore è il diametro del collo del matraccio. Per l'acqua e le sue soluzioni il menisco è concavo. Nel caso del mercurio, il menisco è invece convesso.
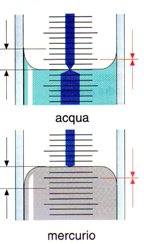
- Inizialmente con una pipetta e infine con un contagocce, si porta a volume. Per non commettere errori la lettura deve essere fatta posizionando gli occhi all'altezza del menisco e aggiungendo liquido in modo che tale che la parte inferiore del menisco sia tangente alla tacca di taratura.
Piaccametro
Il piaccametro è uno strumento utilizzato per la misura del pH.
Consiste di una sonda costituita da un elettrodo combinato e da un dispositivo elettronico che raccoglie i dati della sonda e li trasforma in valori numerici di pH.
L'elettrodo combinato comprende in un unico corpo sia l'elettrodo a vetro che l'elettrodo di riferimento. Il potenziale dell'elettrodo a vetro è sensibile all'attività degl ioni H+, mentre il potenziale dell'elettrodo di riferimento è stabile e costante.
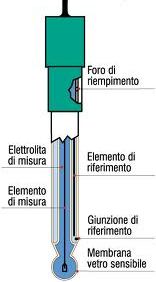
La parte dell'elettrodo sensibile al pH è la sottile membrana di vetro alla base dell'elettrodo.
Sebbene l'elettrodo a vetro sia di gran lunga quello più utilizzato per la misura del pH, esistono molti altri tipi di elettrodi anch'essi sensibili al pH che resistono a condizioni ambientali più difficili di quelle tollerate dall'elettrodo a vetro.
Vi sono vari tipi di piaccametri che possono assumere diverse forme: essere simili a grosse penne sfera dal prezzo accessibile e dalla elevata praticità, ma anche ingombranti apparecchiature che possono essere interfacciate ad un pc.
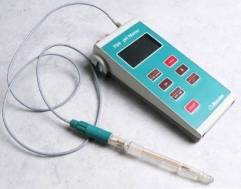
Taratura di un piaccametro
In ogni caso, il piaccametro prima di essere utilizzato deve essere tarato (taratura di un piaccamentro) per mezzo di due o più soluzioni tamponi scelte in modo che il pH del campione incognito rientri nell'intervallo di pH dei due tamponi.
L'esatto procedimento di taratura varia per ciascun modello di piaccametro: sarà bene pertanto consultare il manuale di istruzioni fornito con lo strumento.
Polarimetro
Il polarimetro è uno strumento utilizzato nei laboratori di chimica per la misura del potere rotatorio di una soluzione.
In un polarimetro, la luce ordinaria (di solito una radiazione monocromatica del sodio) entra in un prisma polarizzante di Nicol (polarizzatore) e viene convertita in luce polarizzata, che passa attraverso un tubo contenente il campione per poi arrivare a un altro prisma di Nicol, detto analizzatore.
All'interno del tubo portacampioni viene inserita una sostanza che può fare ruotare il piano della luce polarizzata ed essere quindi otticamente attiva (es. soluzione di acqua e zucchero, trementina, soluzioni di carboidrati, proteine e steroidi). Se la sostanza invece è otticamente inattiva (es. acqua, alcol), il piano della luce polarizzata resta invariato.
Il prisma analizzatore può ruotare e quando è orientato a 90° rispetto al piano della luce polarizzata, la luce non passa e il campo visivo dell'osservatore risulterà nero. Con rotazioni intermedie tra 0° e 90° una certa frazione della luce sarà trasmessa sino all'occhio dell'osservatore e cioè quella frazione che corrisponde alla componente del vettore luminoso nel piano dell'analizzatore. Se il prisma analizzatore è orientato a 0° rispetto al piano della luce polarizzata si ha il massimo valore della luce trasmessa.
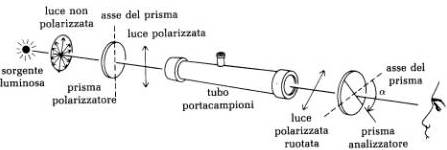
Funzionamento di un polarimetro
Con la sorgente luminosa accesa e il tubo portacampioni vuoto, il prisma analizzatore viene ruotato in modo che il campo visivo dell'osservatore risulti nero. Gli assi del prisma polarizzatore e del prisma analizzatore sono in questo caso disposti a 90° l'uno dall'altro.
Ora il campione da analizzare viene inserito all'inteno del tubo portacampioni. Se la sostanza da analizzare è otticamente inattiva, non farà ruotare il piano della luce polarizzata e il campo visivo dell'osservatore continuerà ad essere nero. Se la sostanza invece è otticamente attiva, il piano della luce polarizzata subirà una rotazione e un pò di luce giungerà all'occhio dell'osservatore. L'asse del prisma analizzatore dovrà essere ruotato di un certo angolo a per rendere il campo visivo nuovamente nero.
L'angolo a viene detto rotazione osservata e corrisponde all'entità della rotazione della luce polarizzata. Questa grandezza dipende da numerosi fattori come la concentrazione della soluzione, la lunghezza del tubo portacampioni, la temperatura, la lunghezza d'onda della sorgente luminosa e la natura del solvente.
Potere rotatorio specifico
Per standardizzare le misure è stato definito il potere rotatorio specifico [a] cioè la rotazione espressa in gradi causata una soluzione con concentrazione pari a un grammo di sostanza per mL di soluzione posta in un tubo portacampioni lungo un decimetro.
Il potere rotatorio specifico viene calcolato con la seguente formula:
Il valore della rotazione può essere oraria (destrorotazione, segno +) o antioraria (levorotazione, segno -)
Nella misura del potere rotatorio specifico devono essere indicate anche: la lunghezza d'onda della luce monocromatica utilizzata nell'analisi, la temperatura, il tipo di solvente e la concentrazione. Ad esempio:
in cui:
25 indica la temperatura di 25°C
D corrisponde alla lunghezza d'onda della luce monocromatica, D indica la riga D del sodio avente lunghezza d'onda pari a 5893 Å (Å = Angstrom)
CHCl3 è il solvente
C=2,05 indica la concentrazione della soluzione
Spettrofotometro UV-Visibile
La spettrofotometria (o spettrometria) UV-visibile si basa sull'assorbimento di radiazioni elettromagnetiche monocromatiche del campo del visibile e dell'UV da parte di molecole.
Questa tecnica trova applicazione nella determinazione qualitativa e quantitativa di numerose sostanze sia organiche che inorganiche nel campo ambientale, farmaceutico e alimentare.
La figura seguente mostra lo schema a blocchi di uno spettrofotometro:
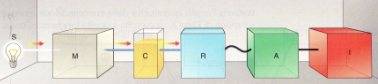
in cui:
S è la sorgente luminosa, che può essere una lampada a incandescenza per le analisi nel campo del visibile o una lampada al deuterio per le analisi nel campo dell'UV.
M è il monocromatore che seleziona e lascia passare la lunghezza d'onda impostata dall'operatore e disperde le altre.
C è la cuvetta che contiene la soluzione da analizzare.
R è il rivelatore che trasforma l'intensità della radiazione elettromagnetica giunta ad esso in un segnale elettrico.
A è l'amplificatore che amplifica il segnale elettrico del rivelatore.
I è il registratore che fornisce il valore di assorbanza.
La parte più importante dello spettrofotometro è sicuramente la cuvetta contenente la soluzione con la sostanza da analizzare.
Supponiamo che sia I0 l'intensità della luce monocromatica incidente. La soluzione assorbe in parte l'intensità della radiazione incidente e all'uscita della cuvetta l'intensità sarà stata ridotta ad un valore che chiamiamo I:
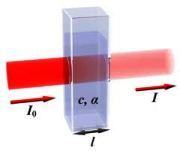
L'assorbimento di luce da parte della soluzione viene definito da una grandezza che prende il nome di assorbanza (A) che viene calcolata con la seguente formula:
in cui T è la trasmittanza, un'altra grandezza fondamentale utile per esprimere l'assorbimento di radiazioni elettromegnetiche.
L'assorbanza A può essere determinata tramite la formula della legge di Lambert-Beer:
ε è il coefficiente di assorbimento molare
l è il cammino ottico cioè lo spessore in cm della soluzione attraversato dalla luce monocromatica
C è la concentrazione della soluzione espressa in termini di molarità.
Le grandezze ε e l sono valori costanti, pertanto l'equazione precedente può essere scritta come:
in cui k = ε · l
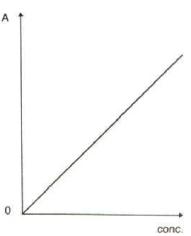
Il grafico di questa equazione è una retta che passa per l'origine degli assi cartesiani in cui k è il coefficiente angolare della retta:
A quale lunghezza d'onda bisogna effettuare l'analisi allo spettrofotometro?
Il grafico seguente mostra come varia il valore dell'assorbanza A di una soluzione 0,001M di KMnO4 in funzione della lunghezza d'onda λ:
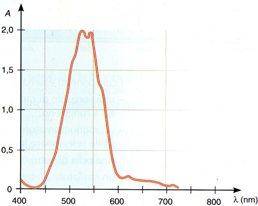
Si può notare che il massimo valore dell'assorbanza si ha alla lunghezza d'onda di 530 nm; pertanto l'analisi di una soluzione incognita di KMnO4 deve essere eseguita a questa lunghezza d'onda.
Termometro
Il termometro è lo strumento con cui viene misurata la temperatura di un corpo.
Esistono vari tipi di termometri tutti basati sulla capacità di rilevare la variazione di una proprietà di un materiale quando questo viene messo a contatto con il corpo di cui vogliamo misurare la tempertura.
I termometri più comuni sfruttano il fenomeno della dilatazione termica, cioè il fatto che in generale i corpi si dilatano, cioè aumentano il proprio volume quando la loro temperatura aumenta e, viceversa, si contraggono, cioè diminuiscono il proprio volume quando la loro temperatura diminuisce.
Alcuni di questi termometri sono costituiti da un sottile tubo di vetro, detto capillare, e da un bulbo contenenti un liquido, che in genere è alcol (in passato era utilizzato il mercurio).
In Italia e in molti altri Paesi il valore della misura che si ottiene con i termometri è determinata in basa alla scala termometrica chiamata scala Celsius, poichè fu ideata nel 1942 dall'astronomo svedese A. Celsius.

Come si costruice la scala termometrica Celsius
Per costruirte la scala termometrica Celsius si immerge il bulbo di un capillare contenente mercurio prima in una miscela di acqua e ghiaccio e successivamente in acqua bollente, segnando sul capillare il livello raggiunto dal mercurio nei due casi. Si assegna il valore zero alla temperatura della miscela acqua-ghiaccio e il valore cento alla temperatura dell'acqua all'ebollizione e poi si divide la distanza tra i due livelli in 100 parti uguali: ognuna di queste rappresenta la variazione unitaria di temperatura, che si chiama grado Celsius.
I termometri tarati in base alla scala Celsius sono senza dubbio i più diffusi, tuttavia esistono anche altre scale termometriche. Nei paesi anglosassoni sono ad esempio in uso termometri che esprimono la temperatura in gradi Fahrenheit. Nel Sistema Internazionale invece si fa riferimento alla cosidetta temperatura assoluta, la cui unità di misura è il Kelvin (K).
4.4. Strumenti per lo scambio termico
Bagno Termostatico
I bagni termostatici sono costituiti da vasche in acciaio inox contenenti acqua termostatata nella quale vengono immersi recipienti da riscaldare.
Sono utilizzati in quelle analisi in cui serve riscaldare in modo uniforme e contemporaneamente più recipienti. Le temperature raggiunte dal bagno sono relativamente basse (circa 80°C) ma il grande vantaggio dei bagni termostatici è dovuta alla rapidità del riscaldamento.

Il riscaldamento tramite bagno termostatico viene spesso preferito a quello a fiamma del Becco Bunsen perchè è possibile evitare riscaldamenti eccessivi per contatto diretto con la fiamma, oltre a spruzzi, che possono provocare decomposizioni indesiderate della sostanza da riscaldare.
La struttura esterna dei bagni termostatici è solitamente realizzata in materiale atermico e antiurto; le vasche di contenimento, realizzate in acciaio inox, sono munite di rubinetto per lo scarico dell'acqua.
Allo scopo di ottenere un buon isolamento termico della struttura, nell'intercapedine tra la struttura esterna e la vasca di contenimento viene inserita della fibra di vetro. Alcuni modelli sono muniti anche di un coperchio realizzato in materiale atermico e antiurto.

Il controllo e la regolazione della temperatura dell'acqua avviene attraverso un termostato con scala graduata.
Becco Bunsen
Il becco Bunsen o semplicemente Bunsen è un bruciatore utilizzato nei laboratori di chimica per il cui uso è necessario seguire determinate norme di sicurezza (al riguardo si veda: norme di sicurezza nell'uso del Bunsen).
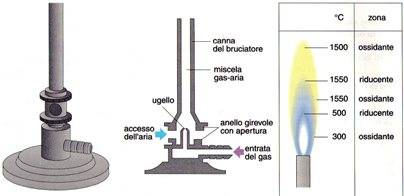
E' formato da un cannello verticale solitamente in acciaio, fissato su una base metallica. E' alimentato a gas di città o a gas metano. Il gas entra nel bruciatore attraverso un iniettore a ugello posto alla base dell'apparecchio ed è possibile regolare la quantità di gas mediante un apposito rubinetto.

Nella parte inferiore, il cannello presenta due fori opposti ed è circondato da un manicotto anche esso fornito di due fori. La quantità di aria aspirata e quindi immessa all'interno della canna del bruciatore, può essere regolata ruotando il manicotto.
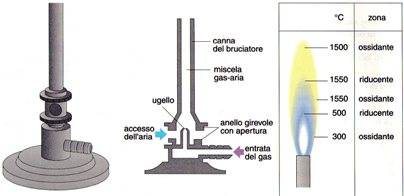
Se i fori presenti nel cannello e quelli presenti sul manicotto non coincidono, la quantità di aria miscelata con il gas è nulla e la fiamma è gialla e poco calda. Se i due fori invece coincidono perfettamente, la quantità di aria miscelata con il gas è massima e la fiamma è di colore azzurro e calda.

Sono in commercio anche becchi Bunsen con sistemi di sicurezza particolarmente indicati per laboratori scolastici. Infatti, se accidentalmente si dovesse spegnere la fiamma del bruciatore, sono muniti di valvola di sicurezza che interrompe immediatamente l'erogazione del gas.
Stufa termostatica
Le stufe elettriche in uso nei laboratori di chimica vengono utlizzate per essiccare precipitati o altre sostanze solide.
Sono costutite da armadi metallici in acciao inox a forma di parallelepipedo. Sono munite di sportello e piani interni forati per favorire la circolazione d'aria. Le pareti e lo sportello delle stufe sono perfettamente coibentate; sono riscaldate elettricamente e al loro interno è possibile raggiungere temperature di 250-300°C. Talvolta sono munite di timer.

Le muffole sono stufe elettriche di materiale refrattario che possono raggiungere i 1800°C.

Vengono utilizzate per la fusione di metalli e la loro calcinazione. I campioni sono contenuti in crogioli che vengono maneggiati con pinze metalliche.
4.5. Strumenti per il trasferimento o il trattamento di sostanze
Becker
I becher sono contenitori generalmente in vetro (ma talvolta anche in plastica), di forma cilindrica, fondo piano e capacità variabile (da 25 mL a 1000 mL).
Quelli in plastica sono realizzati in modo tale da essere autoclavabili, dotati di buona inerzia chimica e resistenza, per brevi periodi, alle alte temperature (anche di 170°C).
Se ne trovano in commercio sia di tarati che di graduati; la taratura però, se presente, è solo indicativa e quindi poco precisa.

I becher vengono utilizzati per diversi scopi tra cui i più importanti sono quelli di contenere ed eventualmente riscaldare liquidi. Non possono essere invece utilizzati per riscaldare sostanze solide.
Becker termostatato
Meno comuni sono i becher termostatati utili per mantenere il campione liquido all'interno del becher ad una temperatura costante.

Beuta
piano e collo cilindrico stretto o largo. Hanno capacità variabile tra 25 mL e 1000 mL e vengono utilizzate, a causa del loro collo stretto, quando si vogliono evitare perdite di liquido per evaporazione.

Le beute possono essere di vari tipi:
- con collo largo
- con collo stretto
- senza tappo con collo rinforzato
- con tappo e collo rinforzato

Beute da vuoto
Le beute codate (o beute da vuoto) sono beute di vetro più spesso, munite di un tubo laterale da utilizzare per collegare, tramite un tubo di gomma, la beuta ad una pompa da vuoto. Servono per la filtrazione sotto vuoto.
Capsula in porcellana
Le capsule di porcellana sono recipienti di forma cilindrica munite di beccuccio di travaso utilizzate nei laboratori di chimica.

Possono essere di due tipi:
- di forma bassa con fondo piano e becco
- emisferiche con fondo piano e becco
Sono di solito smaltate sia internamente che esternamente ad eccezione del fondo esterno del recipiente. Hanno in genere diametri compresi tra gli 8 e i 20 cm.

Data la loro forma e la loro ampia superficie, vengono spesso utilizzate per evaporare liquidi e riscaldare sostanze al becco Bunsen.
Resistono infatti molto bene al calore e possono esser esposte direttamente alla fiamma del Bunsen. Bisogna fare attenzione però al loro raffreddamento che deve essere graduale onde evitare la formazione di crepe o rotture della capsula.
Quando sono calde devono essere afferrate con le apposite pinze da laboratorio.
Capsula in porcellana con manico
Meno frequenti, queste capsule hanno un manico e becco di travaso. La porcellana è ad alta resistenza chimica e termica.
Crogiolo da calcinazione
I crogioli da calcinazione sono recipienti di forma tronco-conica, con fondo piano, completamente verniciati, di diametro variabile da 3 a 5 cm, alti o bassi, muniti di coperchio.
Il coperchio non è a chiusura ermetica: ciò permette agli eventuali gas che si possono sviluppare durante il riscaldamento di fuoriuscire dal crogiolo senza creare situazioni di pericolo.

I crogioli resistono molto bene al calore tanto che possono essere posti direttamente sulla fiamma e arroventati sino al colore rosso. Servono per la calcinazione o per fondere sostanze che richiedono temperature elevate.
Per essere riscaldati alla fiamma del becco Bunsen, i crogioli devono essere incastrati negli appositi triangoli in ferro zincato con barrette in refrattario che vanno posti sopra il treppiede.

L'attrezzatura deve essere montata come nella figura seguente:

Imbuto
Gli imbuti sono attrezzature di forma conica a gambo corto o a gambo lungo costituiti da due tronchi di cono, uno largo (quello nella parte superiore) e il secondo molto più stretto utile per incanalare i liquidi nel contenitore a bocca stretta.
Quelli in uso nei laboratori di chimica sono solitamente in vetro, materiale che garantisce inerzia chimica, perfetta resistenza agli acidi e alle basi, ottima lavabilità; talvolta sono anche in plastica.

Gli imbuti vengono spesso utilizzati nei laboratori di chimica per il travaso di liquidi da un contenitore a bocca larga ad un contenitore a bocca stretta (per sempio beute e provette).
Molto spesso vengono utilizzati anche nel processo di filtrazione al cui interno viene inserito un filtro di carta opportunamente piegato.

Un tipo particolare di imbuto utilizzato per la separazione di liquidi immiscibili è l'imbuto separatore.
Pallone

I palloni sono recipienti a fondo sferico, con collo abbastanza lungo e imboccatura svasata, impiegati nel laboratori di chimica per portare all'ebollizione i liquidi. Hanno capacità variabili tra pochi mL e diversi litri.
Palloni per distillazione
I palloni codati per distillazione o palloni codati sono analoghi ai palloni precedenti, ma il collo è munito di una tubulatura laterale. Come tali sono parte integrante degli apparecchi per la distillazione.

Sotegni per palloni
I sostegni per palloni sono utilizzati per fornire una base di appoggio al pallone. Sono in materiale refrattario, in gomma o in sughero.
Vengono utilizzati come supporto per palloni e devono essere antiscivolo, morbidi e avere una buona resistenza termica

Pipette
Le pipette sono tubi di vetro di varia forma e capacità che permettono il prelievo e la successiva erogazione di liquidi.
Pipetta graduate
Le pipette graduate sono tubi di vetro con la parte inferiore terminante a punta che permettono il prelievo e la successiva erogazione di quantità variabili di liquidi. Sul vetro è stampata la graduazione: è possibile infatti notare una serie di tacche che ne specificano il volume.
Pipette tarate
Le pipette tarate sono tubi di vetro con la parte inferiore terminante a punta che presentano una bolla cilindrica centrale. Sono a volume fisso e quindi permettono il prelievo e la successiva erogazione solo di una specifica quantità di volume.
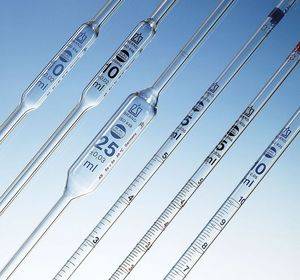
La capacità delle pipette espressa in mL è stampata sul vetro ed è delimitata dalla tacca posta sulla parte superiore della pipetta.
Per entrambi i tipi di pipette, il prelievo e la successiva erogazione del liquido vengono effettuati utilizzando le cosidette propipette.
Come effettuare la misura
La superficie della liquido prelevato tramite pipetta non è piana; il liquido tende ad assumere una forma di calotta sferica che nel caso dell'acqua o di soluzioni acquose è concava (menisco concavo).
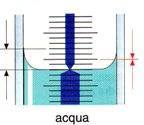
La lettura del volume deve essere effettuata in corrispondenza del punto inferiore del menisco.
Pipetta Pasteur
La pipetta Pasteur è uno speciale tipo di pipetta ideata da Louis Pasteur, chimico francese del XIX secolo.
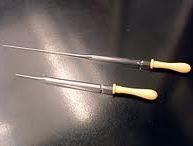
E' costituita da due parti essenziali: una tettarella in gomma e un tubicino sottile in vetro con la parte superiore più larga della parte inferiore che è quasi un capillare.
La tettarella viene inserita nella parte superiore del tubicino.

La pipetta Pasteur viene utilizzata per il dosaggio di liquidi. Non essendo dotata di scala graduata, non viene utilizzata per scopi quantitativi e quindi non può essere utilizzata per misure precise ma solo approssimative.
Utilizzo della pipetta Pasteur
Per l'utilizzo della pipetta Pasteur si procede nel seguente modo:
- si schiaccia la tettarella per provocare la fuoriuscita dell'aria dal tubicino;
- continuando a tenere premuta la tettarella, si inserisce la parte inferiore del tubicino a forma di capillare nel liquido da prelevare;
- si rilascia la tettarella; questo provoca l'aspirazione del liquido che entra pertanto all'interno del tubicino in vetro;
- si inserisce la parte inferiore del tubicino a forma di capillare in un nuovo contenitore e si schiaccia la tettarella per fare fuoriuscire dalla pipetta il liquido precedentemente prelevato.
Propipette
Le propipette sono utilizzate, congiuntamente alle pipette, per l'aspirazione e la successiva erogazione di liquidi.
Sono costituite da un palloncino di gomma con tre valvole:
- la valvola indicata con la sigla A viene utilizzata per l'eliminazione dell'aria all'interno del palloncino di gomma
- la valvola indicata con la sigla S viene utilizzata per l'aspirazione del liquido
- la valvola indicata con la sigla E viene utilizzata per l'erogazione del liquido.

Funzionamento della Propipetta
Per il corretto funzionamento della propipetta, bisogna seguire questi semplici passaggi:
- Si inserisce delicatamente la pipetta nella propipetta.
- Si preme la valvola A, si schiaccia completamente il palloncino e, continuando a tenere premuto il palloncino, si rilascia la valvola A. In questo modo si viene a creare una depressione all'interno della propipetta utile per l'aspirazione del liquido.
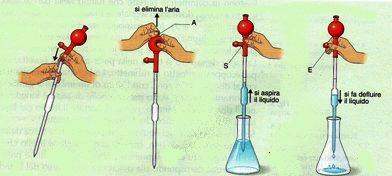
- Si immege l'estremità inferiore della pipetta nel liquido e si aspira il liquido premendo la valvola S.
- Si eroga il liquido premendo la valvola E.
Spruzzetta
Le spruzzette in dotazione ai laboratori di chimica sono contenitori utilizzati per l'erogazione di liquidi. Ne esistono di due tipi: spruzzette in polietilene e spruzzette in vetro.
Spruzzette in polietilene
Le spruzzette in polietilene usate nei laboratori di chimica, sono bottiglie cilindriche flessibili con tappo avvitato, attraverso cui passa un tubo ripiegato e terminante a punta sottile. La semplice pressione della mano sulla bottiglia consente la fuoriuscita del liquido sotto forma di getto sottile.

La spruzzetta riempita di acqua distillata serve per il lavaggio di recipienti, precipitati, ecc. o per aggiungere piccole quantità di acqua distillata.
Spruzzette in vetro
Per i lavaggi con acqua calda vengono utilizzate invece le spruzzette in vetro, costituite da palloni o contenitori cilindrici in vetro, muniti di tappo in gomma attraverso il quale passano due tubicini di vetro.
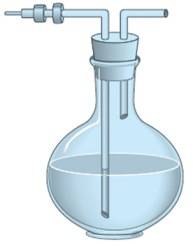
Il tubo di vetro più lungo pesca sul fondo del recipiente ed esternamente è piegato ad angolo acuto.
Il secondo, molto più corto, non pesca all'interno del liquido ed esternamente è piegato ad angolo ottuso. Soffiando all'interno del tubicino più corto, il liquido esce dal primo tubo sotto forma di getto sottile.
Vetrino da orologio
Il vetrino da orologio è un piccolo contenitore di foma circolare, leggermente concavo, con i bordi arrotondati, di diametro variabile tra i 4 e i 15 cm e oltre.
I vetrini da orologio vengono impiegati generalmente per coprire becher durante il processo di evaporazione o di decomposizione. Possono essere utilizzati anche per pesare e contenere piccole quantità di sostanze solide e liquide e osservarne eventualmente le reazioni.
Coprendo il becher con un vetrino da orologio è possibile evitare l'ingresso all'interno del becher di polvere o di altre sostanze indesiderate; l'uso del vetrino da orologio come superficie di evaporazione, invece, facilita l'osservazione della cristalizzazione in modo particolare se il vetrino viene posto su una superficie di colore contrastante.

I vetrini da orologio vengono chiamati in questo modo perchè sono molto simili ai vetrini posti a protezione dei quadranti nei vecchi orologi da taschino.
Principali caratteristiche richiesta ad un vetrino da orologio
Le principali caratteristiche che un vetrino da orologio deve avere sono le seguenti:
- Ottima resistenza ai prodotti chimici;
- Resistente sia alle basse che alle alte temperature;
- Superficie particolarmente liscia per impedire le contaminazioni.
4.6. Strumenti per il supporto
Pinze
Le pinze da laboratorio vengono utilizzate per afferrare oggetti senza esporsi a rischi (es. bruciature).
Esistono due tipi di pinze diverse.
Pinze di metallo
Le pinze di metallo sono solitamente di acciaio inox, a seconda del loro utilizzo possono avere curvature differenti.
Vengono utilizzate solitamente per afferrare capsule e crogioli o altri contenitori.

Pinze di legno
Le pinze di legno sono simili a delle mollette di legno ma hanno un'impugnatura più lunga, in modo da agevolare il loro utilizzo.

Si usano solitamente per portare le provette alla fiamma di un becco Bunsen avendo cura, quando di riscalda, di mantenere la provetta inclinata e di non dirigere l'imboccatura della stessa verso un collega o verso se stessi. In caso contrario, eventuali schizzi fuoriusciti dalla provetta, potrebbere creare seri danni.
Treppiede
I sostegni a treppiede sono costituiti da anelli di ferro sostenuti da tre piedi pure di ferro.

Su questi sostegni si pongono le reticelle metalliche di forma quadrata, costituite da un intreccio di fili di ferro. Sono munite di un disco centrale di materiale refrattario e servono a sostenere becher, beute, capsule, etc.
Alternativamente alle reticelle metalliche, è possibile porre sui treppiedi i sostegni a triangolo: si tratta di sostegni triangolari di filo di ferro rivestiti di materiale refrattario. Servono a sostenere capsule e crogioli durante il riscaldamento diretto alla fiamma del becco Bunsen.

In passato come materiale refrattario utilizzato per produrre sostegni a treppiede e sostegni a triangono veniva utilizzato amianto. E' ora vietato l'impiego di questo materiale perchè le loro fibre se inalate, possono possono portare gravi danni alla salute delle persone.
5. Etichette Chimiche
Indicazioni riportate nell'etichetta di una confezione
Prima di utilizzare in laboratorio qualsiasi sostanza chimica, bisogna leggere con attenzione tutte le indicazioni che sono riportate sull'etichetta dei contenitori.
Sulla etichetta di una sostanza chimica sono indicate:
- Nome del prodotto in varie lingue
- Nome della casa produttrice
- Quantità in grammi ed eventualmente, nel caso di liquidi, anche in ml.
- Formula molecolare, massa molecolare e densità.
- Cas number (Cas.No.).
- Concentrazione delle impurezze presenti
- Informazioni aggiuntive sulla purezza
- Frasi di rischio (R) e frasi di sicurezza (S). Il regolamento CLP entrato in vigore nell'Unione Europea il 20 gennaio 2009, prevede la graduale sostituzione delle "frasi di rischio" con "indicazioni di pericolo" e la sostituzione delle "frasi di prudenza" con "consigli di prudenza".
- Indicazioni sul tipo di pericolo
- Indicazioni sulla concentrazione (se si tratta di una soluzione)

Molto importanti sono le indicazioni di pericolo riportate sull'etichetta.
L'utilizzo di sostanze chimiche pericolose è regolamentato da apposite norme emanate a livello comunitario e recepite dai vari stati membri. Tali norme attribuiscono a ciascun prodotto un simbolo di pericolosità e informazioni riguardanti le indicazioni di pericolo e i consigli di prudenza relativi al loro impiego.

Il Chemical Abstract Service number (Cas number) è un codice formato da tre sequenze di numeri, separate da un trattino, che identifica in modo univoco un composto chimico. Il cas deve essere riportato sulla etichetta di ciascuna sostanza chimica. Ogni sostanza chimica descritta in letteratura viene quindi catalogata dal Chemical Abstract Service (CAS), una divisione della American Chemical Society e gli viene assegnato questo codice univoco.
Il Chemical Abstract Service number dell'acetonitrile è ad esempio 75-05-8, mentre quello dell'acqua è 7732-18-5.
Questi numeri non hanno nessun significato chimico ma identificano unicamente il prodotto. cas number Etichetta dell'acetonitrile con, cerchiato in rosso, il suo Cas number :

Se sono presenti in natura più isomeri dello stesso composto chimico, ad ognuno di essi verrà assegnato il proprio Cas number. Per esempio, il CAS dell' L-glucosio è 921-60-8 mentre quello del suo isomero, il D-glucosio è 50-99-7.
6. Elenco di sostanze chimiche incompatibili
 Molte sostanze chimiche comunemente utilizzate nei laboratori di chimica possono reagire in modo pericoloso quando vengono a contatto con altre sostanze.
Molte sostanze chimiche comunemente utilizzate nei laboratori di chimica possono reagire in modo pericoloso quando vengono a contatto con altre sostanze.
A titolo esemplificativo e non esaustivo, viene riportato un elenco delle più comuni sostanze in uso nei laboratori di chimica e le sostanze a loro incompatibili:
Acetone (CH3COCH3), è incompatibile con: miscele concentrate di acido solforico e nitrico.
Acido acetico (CH3CO2H), è incompatibile con: acido cromico, acido nitrico, composti contenenti idrossili, perossidi, permanganati, glicole etilenico e acido perclorico.
Acido cromico (H2CrO4), è incompatibile con: acido acetico, canfora, naftalene, trementina, glicerolo, alcol e altri liquidi infiammabili.
Acido nitrico (HNO3), è incompatibile con: acido acetico, acido cromico, anilina, idrogeno solforato, carbonio, gas e sostanze che vengono facilmente nitrate.
Acido ossalico (CO2H)2, è incompatibile con: mercurio e argento.
Acido perclorico (HClO4), è incompatibile con: bismuto e sue leghe, anidride acetica, alcol, carta, legno, grassi e altre sostanze organiche.
Acido solfidrico (H2S), è incompatibile con: acido nitrico e ossidanti.
Acido solforico (H2SO4), è incompatibile con: permanganati, clorati, perclorati e acqua.
Alcoli e polialcoli, sono incompatibili con: acido nitrico.
Ammonio nitrato (NH4NO3), è incompatibile con: polveri metalliche, zolfo, acidi e combustibili.
Arsenico (As), è incompatibile con: qualsiasi agente riducente.
Bromo (Br), è incompatibile con: acetilene, ammoniaca, butadiene, butano, carburo di sodio, idrogeno, trementina e metalli finemente polverizzati.
Carbone attivo, è incompatibile con: ipoclorito di calcio e tutti gli agenti ossidanti.
Cianuri (CN-), sono incompatibili con: acidi e alcali.
Clorati (ClO3-), sono incompatibili con: sali di ammonio, zolfo, acidi, polveri metalliche, carbonio, composti organici o infiammabili.
Cloro (Cl2), è incompatibile con: acetilene, butadiene, ammoniaca, idrogeno, carburo di sodio, trementina, metalli finemente polverizzati, benzina e altri derivati del petrolio.
Cloroformio (CHCl3), è incompatibile con: sodio e potassio.
Cloruri (Cl-), sono incompatibili con: acido solforico.
Diclorometano (CH2Cl2), è incompatibile con: sodio e potassio.
Idrocarburi, sono incompatibili con: acido formico, fluoro, cloro, perossido di sodio, acido cromico.
Iodio (I2), è incompatibile con: ammoniaca e acetilene.
Ipocloriti (ClO-), sono incompatibili con: carbone attivo e acidi.
Liquidi infiammabili, sono incompatibili con: acido cromico, perossido di idrogeno, perossido di sodio, alogeni, nitrato di ammonio, acido nitrico.
Mercurio (Hg), è incompatibile con: idrogeno, acido fulminico, acetilene.
Calcio (Ca), potassio (K) e sodio (Na), sono incompatibili con: acqua, diossido di carbonio, tetracloruro di carbonio e altri idrocarburi clorurati.
Nitrati (NO3-) e nitriti (NO2-), sono incompatibili con: acidi.
Ossido di calcio (CaO), è incompatibile con: acqua
Perclorato di potassio (KClO4), è incompatibile con: acido solforico e altri acidi.
Permanganato di potassio (KMnO4), è incompatibile con: glicerolo, glicole etilenico, acido solforico e benzaldeide.
Perossido di idrogeno (H2O2), è incompatibile con: anilina, nitrometano, liquidi infiammabili, ferro, rame, cromo e la maggior parte degli altri metalli e loro sali. Potassio, è incompatibile con: acqua, cloroformio, tetracloruro di carbonio, diossido di carbonio e diclorometano.
Rame (Cu), è incompatibile con: acetilene, perossido di idrogeno e azide.
Solfuri (S2-), sono incompatibili con: acidi forti.
Tetracloruro di carbonio (CCl4), è incompatibile con: potassio e sodio.


![[\alpha ] = {{rotazione~osservata} \over {lunghezza~del~tubo~(dm) \cdot concentrazione~(g/cm^3)}} [\alpha ] = {{rotazione~osservata} \over {lunghezza~del~tubo~(dm) \cdot concentrazione~(g/cm^3)}}](https://minerva.ic.cnr.it/filter/tex/pix.php/8c39424cf086115fa35ed4aeae1380ca.gif)
![[\alpha ]^{25}_{D} = {-32,2°~CHCl_3~(c=2,05)} [\alpha ]^{25}_{D} = {-32,2°~CHCl_3~(c=2,05)}](https://minerva.ic.cnr.it/filter/tex/pix.php/27bc1749d2e6e2dc98af721faca968c9.gif)